Terapia genetica
Certaines maladies pourraient être soignées si l’on réussissait à introduire un gène thérapeutique dans les cellules de l’organe malade. Lors d’une thérapie génique par exemple, le gène thérapeutique assume le rôle du gène défectueux et, ainsi, restaure la capacité fonctionnelle de l’organe malade. Plusieurs méthodes ont été élaborées afin d’acheminer le gène thérapeutique dans les cellules cibles. Des virus modifiés jouent le rôle de véhicules de transport, on les appelle des vecteurs.
Autant qu’il le faut et le moins possible
Pour faire d’un virus un véhicule sûr et efficace, la première étape consiste à éliminer tous les gènes responsables de ses propriétés pathogènes ou de sa capacité à se reproduire dans les cellules hôtes. Puis, les gènes nécessaires à l’élaboration de ses différents éléments constitutifs sont isolés. Enfin, le virus est produit par culture cellulaire (c’est à dire par des cellules cultivées dans un milieu nutritif). Dans ce but, les gènes codant pour les éléments constitutifs du virus ainsi que le gène thérapeutique sont introduits indépendamment dans les cellules. Celles-ci produisent tous les éléments du virus et y incluent le gène thérapeutique. Seul le gène thérapeutique est intégré dans le vecteur car seul celui-ci est muni d’un signal d’inclusion spécifique (voir illustration).
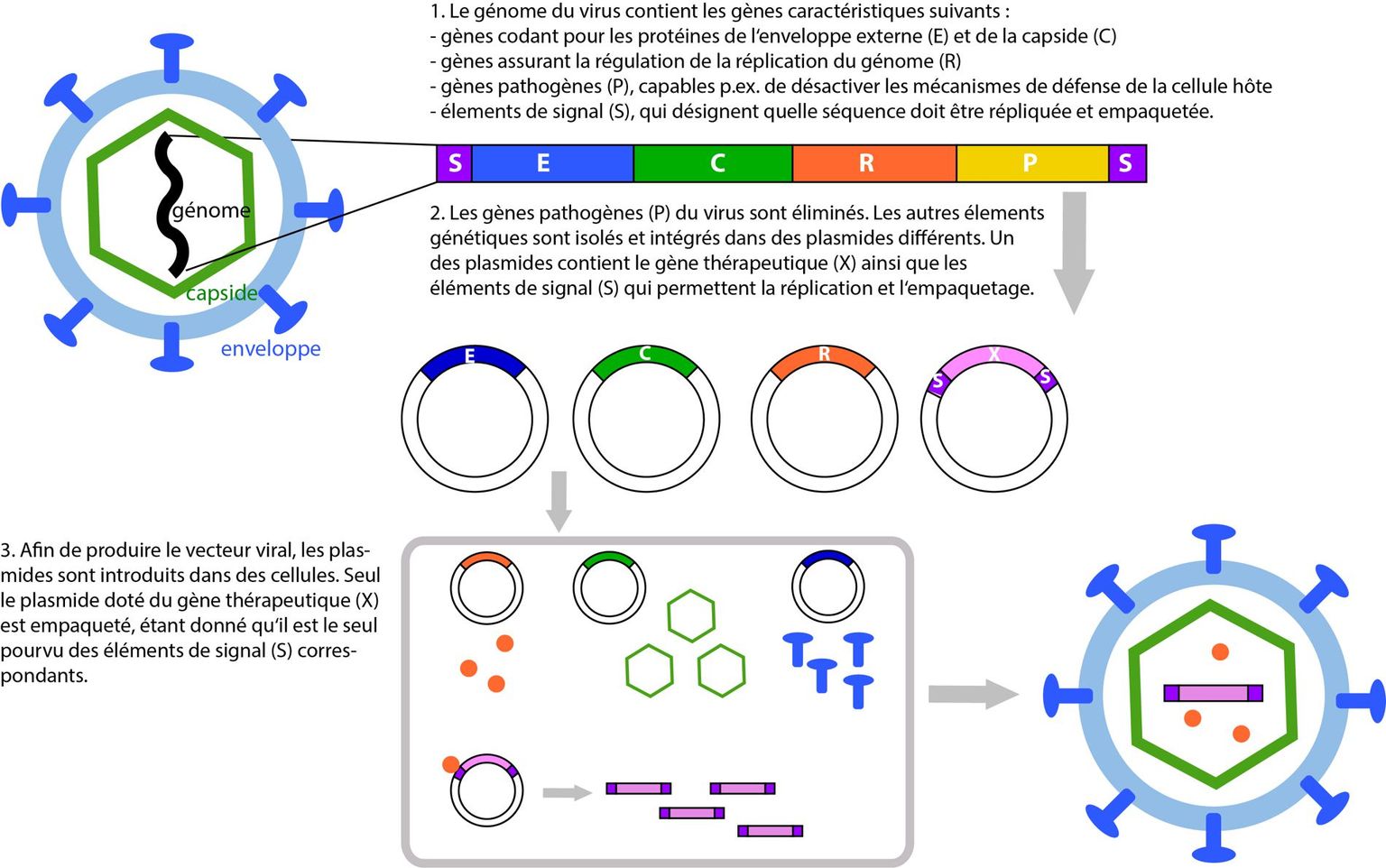
Ce procédé de production de vecteurs représente un stade préliminaire à la biologie synthétique. La production des premiers vecteurs ayant reposé essentiellement sur l’usage de séquences virales existant dans la nature, cette approche s’avère plus proche du génie génétique conventionnel (biotechnologie) que de la biologie synthétique.
Meilleure spécificité des vecteurs artificiels
La méthode esquissée ci-dessus a fait l’objet de différents développements par la suite.
Dans une thérapie génique, il est essentiel que le vecteur reconnaisse les cellules malades, s’y lie et y intègre le gène thérapeutique. Les virus possèdent une enveloppe interne – la capside – leur permettant de reconnaître différents types cellulaires selon leur structure membranaire et de s’y fixer. Certains virus ont une capside et une enveloppe qui entoure cette capside. Pour atteindre les cellules d’intérêt, il faut choisir une capside (ou enveloppe) qui leur est spécifique. Cette capside peut provenir d’un autre virus, être modifiée génétiquement ou générée synthétiquement. Les approches génétiques et synthétiques permettent en outre d’atteindre des types cellulaires qu’aucun des virus connus n’est capable de reconnaître. Une technique quelque peu différente consiste à insérer dans l’enveloppe de courtes séquences de protéines ou d’anticorps. Ces protéines additionnelles se lient à des molécules spécifiques à la surface des cellules cibles et permettent aux vecteurs de se fixer à ces dernières.
Des gènes thérapeutiques contrôlables
Il est également possible de concevoir le gène thérapeutique de manière à pouvoir contrôler ses activités, par exemple au moyen d’une substance active. Pour cela, le gène thérapeutique est combiné à une séquence d’ADN régulatrice appropriée, appelée promoteur. Le promoteur est choisi de sorte à répondre à la substance active en allumant ou éteignant le gène thérapeutique suivant les cas.1
Enfin le gène thérapeutique peut provenir de l’homme ou d’un autre organisme, ou même être produit artificiellement. Par exemple, l’approche optogénétique, développée récemment et qui consiste à activer une cellule au moyen d’un stimulus lumineux repose sur l’usage d’un gène provenant d’un microorganisme dont il contrôle le mouvement des flagelles par l’intermédiaire des protéines qu’il engendre. Cette approche pourrait être utilisée entre autres afin de restaurer la vue chez des patients dont les récepteurs oculaires à la lumière sont défectueux voire totalement absents.2 Dans plusieurs maladies psychiques par contre, la recherche vise à modifier, en l’améliorant, l’activité des cellules nerveuses et une possibilité serait de créer des canaux ioniques artificiels. Ebauchés il y a plus de 30 ans, ceux-ci peuvent se construire en laboratoire aujourd’hui.3
Une combinaison des approches décrites ci-dessus est aussi possible. Elle permet d’envisager, du moins en principe, une stratégie thérapeutique consistant à intégrer dans l’organe malade un gène thérapeutique synthétique contrôlé par un promoteur synthétique grâce à un vecteur qui n’existe pas en tant que tel dans la nature.
Développer de nouvelles voies métaboliques cellulaires
Les stratégies évoquées ci-dessus ont encore progressé en combinant transfert de cellules et transfert de gènes pour restaurer la capacité fonctionnelle d’un organe malade. Le groupe de recherche de Martin Fussenegger de l’ETH Zürich à Bâle a ainsi développé une thérapie permettant de traiter le diabète – jusqu’ici chez la souris seulement.4 Le taux de sucre dans le sang est contrôlé par une hormone, l’insuline, secrétée dans le pancréas. Chez le diabétique le taux de sucre dans le sang est trop élevé à cause d’une perturbation de l’action de l’insuline.
L’approche thérapeutique du groupe de l’ETH Zürich a été, dans un premier temps, de modifier des cellules génétiquement de manière à ce que celles-ci libèrent une substance active sous le contrôle de la lumière. Les cellules ont été rendues photosensibles par l’intégration du récepteur mélanopsine. En parallèle, les cellules ont reçu un gène codant pour l’hormone GLP-1 qui stimule la production d’insuline dans le pancréas. Le gène GLP-1 a été placé à côté d’un promoteur spécifique qui assure que le gène ne produise l’hormone GLP-1 que lorsque la lumière atteint le récepteur photosensible mélanopsine (cf schéma).
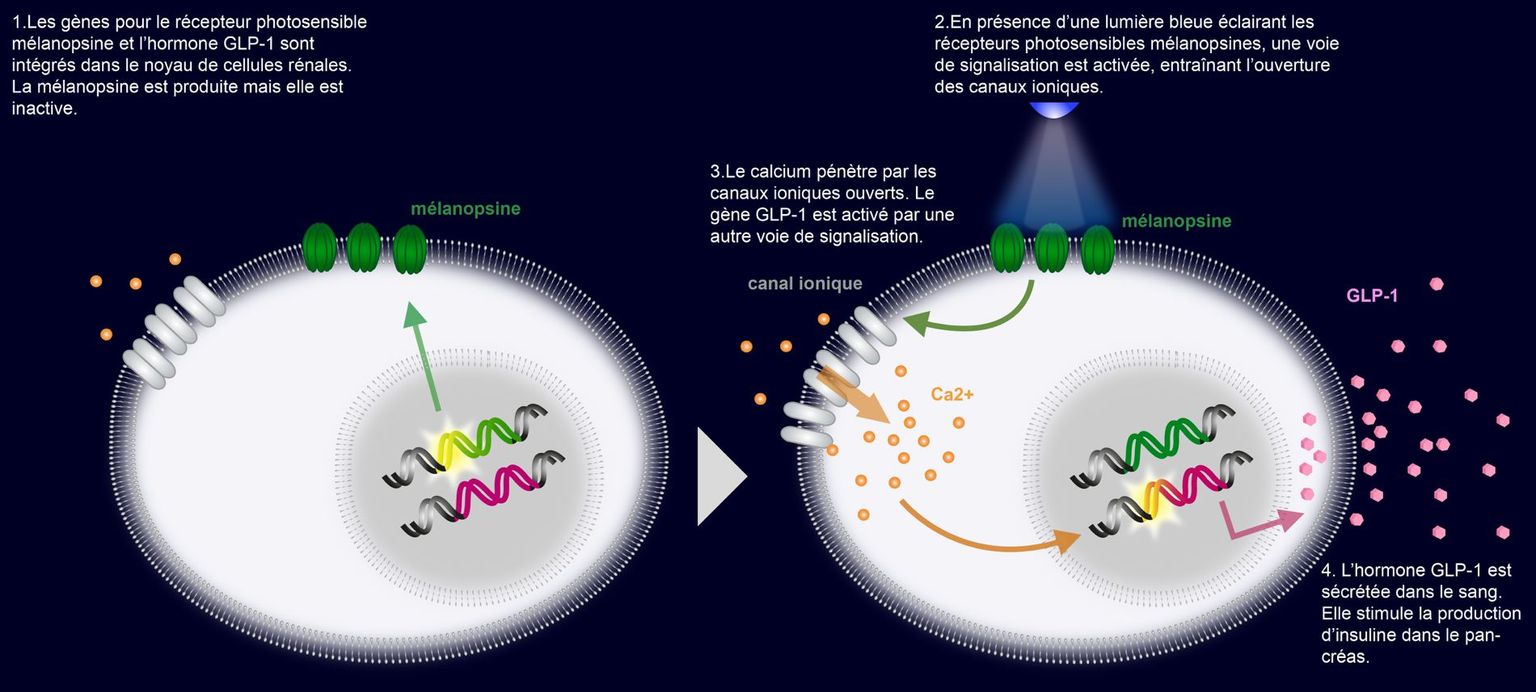
Dans un deuxième temps, les cellules équipées des gènes mélanopsine et GLP-1 ont été intégrées dans des microcapsules et celles-ci transplantées sous la peau de souris diabétiques. Lorsque les souris sont placées sous une source lumineuse, les cellules produisent l’hormone GLP-1 qui stimule la production d’insuline et entraîne, par conséquent, la diminution du taux de sucre dans le sang. Cet exemple montre que, grâce à la biologie synthétique, il est possible de concevoir et construire à des fins thérapeutiques des cellules dotées de propriétés nouvelles.
Défis
Le but d’une thérapie génique est de remplacer un gène défectueux par une séquence intacte et, ainsi, de restituer une fonction perdue. Cette thérapie se fait dans le même esprit que la transplantation de cellules ou d’organes. Cependant la démarche optogénétique va plus loin : les cellules nerveuses sont équipées de récepteurs photosensibles et peuvent, de ce fait, être stimulées et contrôlées par des stimuli externes. Lorsque l’approche optogénétique est utilisée afin de rendre la vue, elle ressemble beaucoup à la thérapie génique puisque les nouveaux récepteurs photosensibles thérapeutiques remplacent une fonction naturelle qui a été perdue. Mais si cette technique était utilisée pour contrôler certains circuits cérébraux – par exemple pour aller à l’encontre d’un processus épileptique5 ou d’un comportement pathologique6 -, elle permettrait de contrôler le cerveau d’une manière nouvelle, impossible sous cette forme jusqu’ici. Une telle application pourrait avoir des conséquences sociétales importantes, à l’instar du développement des antipsychotiques dans les années 1960, mais avec la capacité nouvelle de pouvoir atteindre spécifiquement chaque type de cellules nerveuses. De telles approches thérapeutiques visant à contrôler les activités cérébrales ne seront cependant pas appliquées à l’homme dans un proche avenir. Mais qu’elles soient réalisables en principe, on peut déjà le montrer. Il est donc important de discuter dès maintenant des applications possibles et des limites éthiques éventuelles, en portant une attention particulière au traitement des maladies psychiques.
Activités suisses
En Suisse, plusieurs groupes de recherche sont actifs dans le domaine de la thérapie génique.
Deux examples:
Botond Roska, Friedrich Miescher Institut, Bâle
Exploration des circuits neuronaux au moyen de la biologie moléculaire et du génie génétique. Lien
Martin Fussenegger, ETH Zurich
Développement de traitements thérapeutiques médicaux: des médicaments biologiques jusqu’à la construction de tissus en passant par la thérapie génique. Lien
Littérature
- Guo ZS et al. (2008) Gene transfer: the challenge of regulated gene expression. Trends in Molecular Medicine. 14: 410-418. Lien
- Busskamp VS et al. (2012) Optogenetic therapy for retinitis pigmentosa. Gene Therapy 19: 169-175. Lien
- Sakai N and Matile S (2013) Synthetic ion channels. Langmuir. 29: 9031-9040. Lien
- Ye H et al. (2011) A synthetic optogenetic transcription device enhances blood-glucose homeostasis in mice. Science. 332: 1565-1568. Lien
- Walker MC et al. (2013) Gene therapy in status epilepticus. Epilepsia. 54 (6): 43-45. Lien
- Dias BG et al. (2013) Towards new approaches to disorders of fear and anxiety. Current Opinion in Neurobiology. 23: 346-352. Lien


